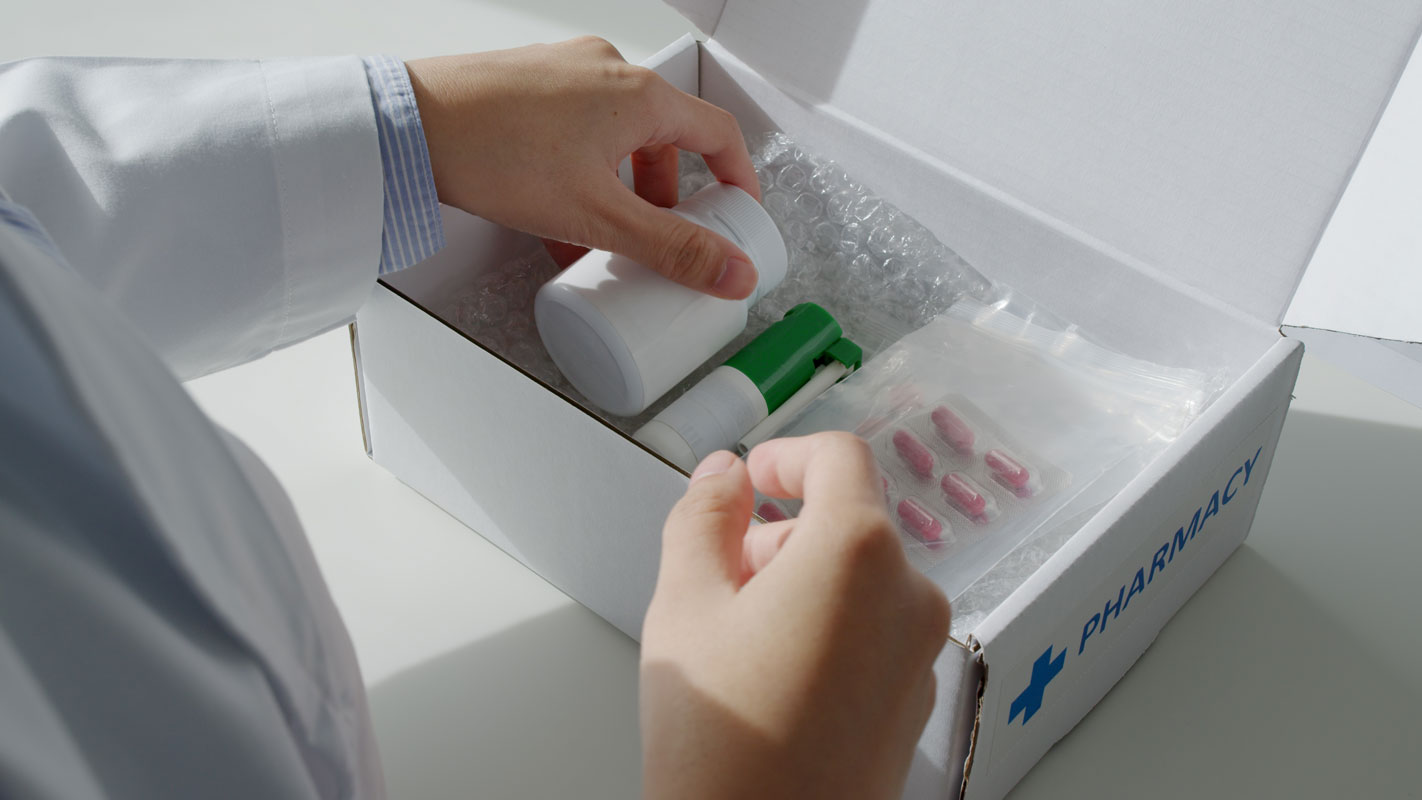
Il deblistering, la pratica di sconfezionare e riconfezionare in maniera personalizzata i medicinali per favorire l’aderenza alla terapia di pazienti cronici o in pluriterapia è ancora priva di una disciplina organica a livello nazionale.
L’esperienza regionale sul deblistering dei farmaci
Le esperienze regionali si sono moltiplicate in questi anni, come abbiamo ricordato in questo articolo del blog e, con una mozione del 9 luglio scorso, a Lombardia Veneto Emilia Romagna e Lazio, si aggiunge ora la Liguria (Fonte FPress).
Il provvedimento, adottato all’unanimità dal Consiglio regionale ha espressamente ribadito l’intenzione di promuovere un progetto operativo per identificare le migliori modalità con cui sviluppare il modello di deblistering.
Il deblistering veterinario
Sull’utilità del servizio di deblistering sembrano essere tutti d’accordo, ma l’assenza di una disciplina organica, costringe le Regioni ad esperienze di sperimentazione.
La Lombardia ha pubblicato già nel 2011 le sue linee guida e le esperienze sui farmaci veterinari su base nazionale, avviata con la bozza di Decreto legislativo di attuazione del Regolamento Ue 2019/6, consente già ora ai farmacisti di confezionare direttamente i medicinali veterinari nella quantità più aderenti al piano terapeutico indicato dal veterinario curante.
Il deblistering come buona pratica terapeutica
Il servizio di confezionamento personalizzato dei farmaci nelle farmacie della Regione sarà a supporto dell’aderenza terapeutica di quei pazienti, spesso fragili e anziani oggetto di politrattamenti, che potranno giovarsi della fornitura, da parte delle farmacie, della terapia personalizzata, così da ridurre gli errori, migliorare l’efficacia e in generale la gestione dell’esperienza terapeutica.
I vantaggi del deblistering sono notevoli, per i pazienti soprattutto, ma anche per ambiente e farmacisti.
Le criticità, invece, a cui il modello di riconfezionamento può esporsi riguardano tuttavia alcuni aspetti non secondari, quali:
- la comunicazione sugli effetti dei farmaci (bugiardini), che devono essere in quantità sufficiente a coprire le forniture personalizzate
- le scelte di packaging delle confezioni da inviare ai farmacisti;
- l’impatto delle scatole più grandi sulla logistica della distribuzione;
- l’assenza di norme chiare sulla sicurezza degli ambienti di stoccaggio e i controlli sulle scadenze;
- la necessità -eventuale- di richiedere nuove autorizzazioni (AIC);
- la tracciabilità, marcatura anticontraffazione ed etichettatura dei farmaci;
e molto altro ancora.
L’adozione di nuove sperimentazioni normative su base regionale per il deblistering, se non arrivasse in tempi brevi un coordinamento a livello nazionale potrebbe influenzare, tanto l’industria produttiva dei farmaci, tanto la filiera della distribuzione.